Nội Dung
Hướng dẫn giải Bài 17. Phản ứng oxi hoá – khử sgk Hóa Học 10. Nội dung bài Giải bài 1 2 3 4 5 6 7 8 trang 82 83 sgk Hóa Học 10 bao gồm đầy đủ phần lý thuyết và bài tập, đi kèm công thức, phương trình hóa học, chuyên đề… có trong SGK để giúp các em học sinh học tốt môn hóa học 10, ôn thi tốt nghiệp THPT quốc gia.
LÍ THUYẾT
I – Phản ứng oxi hóa – khử
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
– Chất khử (chất bị oxh) là chất nhường electron
– Chất oxh (chất bị khử) là chất thu electron.
– Quá trình oxh (sự oxh) là quá trình nhường electron.
– Quá trình khử (sự khử) là quá trình thu electron.
II – Lập phương trình hóa học của phản ứng oxi hóa khử
Để lập phương trình phản ứng oxi hoá – khử theo phương pháp tháng bằng electron, ta thực hiện các bước sau đây:
– Bước 1 : Ghi số oxi hoá của những nguyên tố có số oxi hoá thay đổi:
– Bước 2 : Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
– Bước 3: Tìm hệ số thích hợp sao cho tổng số electron do chất khử nhường bằng tổng số electron mà chất oxi hoá nhận.
– Bước 4: Đặt hệ số của các chất oxh và khử vào sơ đồ phản ứng, từ đó tính ra hệ số các chất khác. Kiểm tra cân bằng số nguyên tử của các nguyên tố và cân bằng điện tích hai vế để hoàn thành PTHH.
Ví dụ:
\(F{{e}_{2}}{{O}_{3}}\,\,\,+{{H}_{2}}\,\,\,\xrightarrow{{{t}^{o}}}\,\,\,Fe\,\,\,+\,\,\,{{H}_{2}}O\)
– Bước 1: Xác định số oxi hóa, chất oxi hóa, chất khử
\(\overset{+3}{\mathop{F{{e}_{2}}}}\,{{O}_{3}}\,\,\,+\,\,\,\overset{0}{\mathop{{{H}_{2}}}}\,\,\,\,\xrightarrow{{{t}^{o}}}\,\,\,\overset{0}{\mathop{Fe}}\,\,\,\,+\,\,\,{{\overset{+1}{\mathop{H}}\,}_{2}}O\)
Chất oxi hóa : \(\overset{+3}{\mathop{Fe}}\,\) (trong Fe2O3)
Chất khử : \(\overset{0}{\mathop{{{H}_{2}}}}\,\)
– Bước 2: Viết các quá trình oxi hóa, khử
\(\overset{+3}{\mathop{F{{e}_{2}}}}\,{{O}_{3}}\,\,\,+\,\,\,2.3e\,\,\,\to \,\,\,2\overset{0}{\mathop{Fe}}\,\)
(quá trình khử)
\(\overset{0}{\mathop{{{H}_{2}}}}\,\,\,\,\,\,\,\to \,\,\,\overset{+1}{\mathop{{{H}_{2}}O}}\,\,\,\,+2.1e\)
(quá trình oxi hóa)
– Bước 3: Tìm hệ số cho hai quá trình oxi hóa và khử
Bội số chung nhỏ nhất (BSCNN) = 6 do đó hệ số mỗi quá trình như sau :
1 \(\overset{+3}{\mathop{F{{e}_{2}}}}\,{{O}_{3}}\,\,\,+\,\,\,2.3e\,\,\,\to \,\,\,2\overset{0}{\mathop{Fe}}\,\)
3 \(\overset{0}{\mathop{{{H}_{2}}}}\,\,\,\,\,\,\,\to \,\,\,\overset{+1}{\mathop{{{H}_{2}}O}}\,\,\,\,+2.1e\)
Bước 4: Viết PTHH
⇒ Fe2O3 + 3H2 → 2Fe + 3H2O
III – Ý nghĩa của phản ứng oxi hóa – khử
– Phản ứng oxi hóa – khử là một trong những quá trình quan trọng nhất của thiên nhiên: Sự hô hấp, quá trình thực vật hấp thụ khí cacbonic giải phóng oxi, sự trao đổi chất và hàng loạt quá trình sinh học khác đều có cơ sở là các phản ứng oxi hóa – khử.
– Ngoài ra: Sự đốt cháy nhiên liệu trong các động cơ, các quá trình điện phân, các phản ứng xảy ra trong pin và trong ăcquy đều bao gồm sự oxi hóa và sự khử. Hàng loạt quá trình sản xuất như luyện kim, chế tạo hóa chất, chất dẻo, dược phẩm, phân bón hóa học, … đều không thực hiện được nếu thiếu các phản ứng oxi hóa – khử.
BÀI TẬP
Dưới đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 trang 82 83 sgk Hóa Học 10 đầy đủ và ngắn gọn nhất. Nội dung chi tiết bài giải các bài tập các bạn xem sau đây:
1. Giải bài 1 trang 82 hóa 10
Cho các phản ứng sau :
A. 2HgO \( \xrightarrow[]{t^{0}}\) 2Hg + O2
B. СаСОз \( \xrightarrow[]{t^{0}}\) CaO + CO2.
C. 2Al(OH)3 \( \xrightarrow[]{t^{0}}\) Al2O3 + 3H2O
D. 2NaHCO3 \( \xrightarrow[]{t^{0}}\) Na2CO3 + CO2 + H2O
Phản ứng nào là phản ứng oxi hoá – khử.
Bài giải:
Những phản ứng theo đề bài cho, phản ứng oxi hóa khử là:
\(2HgO\xrightarrow{{{t^0}}}2Hg + {O_2}\)
Hg2+ + 2e \( \to\) Hg0
2O2- \( \to\) O2 + 4e
Còn các phản ứng khác không phải là phản ứng oxi hóa khử
⇒ Đáp án: A.
2. Giải bài 2 trang 82 hóa 10
Cho các phản ứng sau :
A. 4NH3 + 5O2 \(\xrightarrow[{xt}]{{{t^0}}}\) 4NO + 6H2O
B. 2NH3 + 3Cl2 —> N2 + 6HCl
C. NH3 + 3CuO \(\xrightarrow{{{t^0}}}\) 3Cu + N2 + 3H2O
D. 2NH3 + H2O2 + MnS04 —> Mn02 + (NH4)2SO4.
Ở phản ứng nào NH3 không đóng vai trò chất khử ?
Bài giải:
Ở phản ứng A, B, C: số oxi hóa của NH3 đều tăng sau phản ứng ⇒ đóng vai trò là chất khử.
⇒ ở phản ứng D: NH3 đóng vai trò là môi trường.
⇒ Đáp án: D.
3. Giải bài 3 trang 83 hóa 10
Trong số các phản ứng sau:
A. HNO3 + NaOH → NaNO3 + H2O
B. N2O5+ H2O → 2HNO3
C. 2HNO3 + 3H2S → 3S + 2NO + 4H2O
D. 2Fe(OH)3 → Fe2O3 + 3H2O.
Phản ứng nào là phản ứng oxi hoá – khử.
Bài giải:
Trong các phản ứng trên chi có phản ứng C là phản ứng oxi hoá – khử vì có sự thay đổi số oxi hoá của các nguyên tố.
![]()
⇒ Đáp án: C.
4. Giải bài 4 trang 83 hóa 10
Trong phản ứng : 3NO2 + H2O → 2HNO3 + NO
NO2 đóng vai trò gì ?
A. Chỉ là chất oxí hoá.
B. Chỉ là chất khử.
C. Là chất oxi hoá, nhưng đồng thời cũng là chất khử.
D. Không là chất oxi hoá, không là chất khử.
Chọn đáp án đúng.
Bài giải:
NO2 đóng vai trò vừa là chất oxi hoá vừa là chất khử
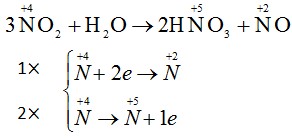
⇒ Đáp án: C.
5. Giải bài 5 trang 83 hóa 10
Phân biệt chất oxi hoá và sự oxi hoá, chất khử và sự khử. Lấy thí dụ để minh họa.
Bài giải:
– Chất oxi hoá là chất nhận electron.
– Sự oxi hoá một chất là làm cho chất đó nhường electron.
– Chất khử là chất nhường electron.
– Sự khử một chất là sự làm cho chất đó thu electron.
Thí dụ: Fe + CuSO4 → FeSO4 + Cu
Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự oxi hoá nguyên tử sắt.
Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
6. Giải bài 6 trang 83 hóa 10
Thế nào là phản ứng oxi hoá – khử ? Lấy ba thí dụ.
Bài giải:
Phản ứng oxi hoá – khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng.
Thí dụ:
\(\\ \overset{0}{H_{2}} + \overset{0}{Cl_{2}} \xrightarrow[\ ]{ \ a’s \ } 2\overset{+1}{H} \overset{-1}{Cl}\)
\(\\ \overset{0}{Fe} + 2\overset{+1}{H}Cl \xrightarrow[ \ ]{ \ \ \ } \overset{+2}{Fe}Cl_{2} + \overset{0}{H_{2}}\)
\(\\ 2FeCl_{2} + \overset{0}{Cl_{2}} \xrightarrow[ \ ]{ \ \ \ } 2\overset{+3}{Fe} \overset{-1}{Cl_{3}}\)
7. Giải bài 7 trang 83 hóa 10
Lập phương trình phản ứng oxi hoá – khử sau đây theo phương pháp thăng bằng electron :
a) Cho MnO2 tác dụng với dung dịch axit HCl đặc, thu được MnCl2, Cl2 và H2O.
b) Cho Cu tác dụng với dung dịch axit HNO3 đặc, nóng thu được Cu(NO3)2, NO2 và H2O.
c) Cho Mg tác dụng với dung dịch axit H2SO4 đặc, nóng thu được MgSO4, S và H2O.
Bài giải:
a) MnO2 tác dụng với dung dịch axit HCl đặc:
\(\\ \overset{+4}{Mn}O_{2} + 4H\overset{-1}{Cl_{d}} \xrightarrow[ \ ]{ \ t^0} \overset{+2}{Mn}Cl_{2} + \overset{0}{Cl_{2}} + 2H_{2}O\)
\(\\ \begin{matrix} 1 \times \\ \ \\ 1 \times \end{matrix} \left\{\begin{matrix} \overset{+4}{Mn} + 2e \rightarrow \overset{+2}{Mn} \\ \ \\ 2\overset{-1}{Cl} \rightarrow Cl_{2} + 2e \end{matrix}\right.\)
b) Cu tác dụng với dung dịch axit HNO3 đặc, nóng
\(\\ \overset{0}{Cu} + 4H\overset{+3}{N}O_{3 \ d} \xrightarrow[ \ ]{ \ t^0 } \overset{+2}{Cu}(NO_{3})_{2} + 2\overset{+4}{N}O_{2} + 2H_{2}O\)
\(\\ \\ \begin{matrix} 1 \times \\ \ \\ 1 \times \end{matrix}\left\{\begin{matrix} \overset{+4}{Mn} + 2e \rightarrow \overset{+2}{Mn} \\ \ \\ 2\overset{-1}{Cl} \rightarrow Cl_{2} + 2e \end{matrix}\right.\)
c) Mg tác dụng với dung dịch axit H2SO4 đặc, nóng
\(\\ 3\overset{0}{Mg} + 4H_{2}\overset{+6^0}{S}O_{4} \xrightarrow[ \ ]{ \ t^0 } 3\overset{+2}{Mg}SO_{4} + \overset{0}{S} \downarrow + 4H_{1}O \)
\(\\ \begin{matrix} 3 \times \\ \ \\ 1 \times \end{matrix} \left\{\begin{matrix} \overset{0}{Mg} \rightarrow \overset{+2}{Mg} + 2e \\ \ \\ \overset{+6}{S} + 6e \rightarrow \overset{0}{S} \ \ \ \ \end{matrix}\right.\)
8. Giải bài 8 trang 83 hóa 10
Cần bao nhiêu gam đồng để khử hoàn toàn lượng ion bạc có trong 85 ml dung dịch AgNO3 0,15M ?
Bài giải:
Ta có:
\( n_{AgNO_{3}}\) = \( \dfrac{0,15.85}{1000}\) = 0,01275 mol
Phương trình hoá học của phản ứng:
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
1mol 2mol
x mol ← 0,01275 mol
x = \( \dfrac{0,01275}{2}\) = 0,006375 mol
mCu tham gia phản ứng: 0,006375 x 64 = 0,408 g.
Bài trước:
Bài tiếp theo:
Xem thêm:
- Để học tốt môn Toán 10
- Để học tốt môn Vật Lí 10
- Để học tốt môn Hóa Học 10
- Để học tốt môn Sinh Học 10
- Để học tốt môn Ngữ Văn 10
- Để học tốt môn Lịch Sử 10
- Để học tốt môn Địa Lí 10
- Để học tốt môn Tiếng Anh 10
- Để học tốt môn Tiếng Anh 10 (Sách Học Sinh)
- Để học tốt môn Tin Học 10
- Để học tốt môn GDCD 10
Trên đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 8 trang 82 83 sgk Hóa Học 10 đầy đủ, ngắn gọn và dễ hiểu nhất. Chúc các bạn làm bài môn hóa học 10 tốt nhất!
“Bài tập nào khó đã có giaibaisgk.com“
