Nội Dung
Hướng dẫn giải Bài 16: Phương trình hóa học, sách giáo khoa Hóa học 8. Nội dung bài Giải bài 1 2 3 4 5 6 7 trang 57 58 sgk Hóa học 8 bao gồm đầy đủ đầy đủ lý thuyết, công thức, phương trình hóa học, chuyên đề hóa học, … có trong SGK để giúp các em học sinh học tốt môn hóa học lớp 8.
Lý thuyết
I. Lập phương trình hóa học
1. Phương trình hóa học
Phương trình chữ của phản ứng: Hiđrô + Ôxi → Nước
Sơ đồ phản ứng: H2 + O2 (dashrightarrow) H2O
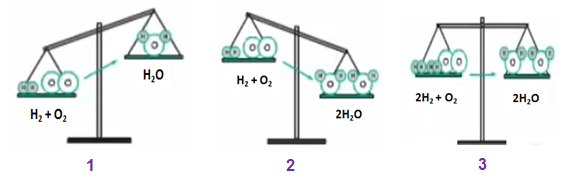
– Ở hình 1: Nếu theo sơ đồ phản ứng H2 + O2 \(\dashrightarrow\) H2O thì:
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O.
+ Vế phải: 2 nguyên tử H và 1 nguyên tử O.
⇒ Vế trái sẽ có khối lượng nhiều hơn vì hơn 1 nguyên tử O.
– Ở hình 2: Nếu vế trái nhiều hơn 1 nguyên tử O thì ta thêm hệ số 2 trước vế phải. Lúc này:
+ Vế trái: 2 nguyên tử H và 2 nguyên tử O.
+ Vế phải: 4 nguyên tử H và 2 nguyên tử O.
⇒ Vế phải có khối lượng nhiều hơn, do hơn 2 nguyên tử H.
– Ở hình 3: Ta thêm hệ số 2 vào trước H2 và H2O:
Vế trái: 4 nguyên tử H và 2 nguyên tử O.
Vế phải: 4 nguyên tử H và 2 nguyên tử O.
⇒ Khối lượng của hai vế bằng nhau.
– Kết luận:
Phương trình hóa học: 2H2 + O2 → 2H2O
Phương trình hóa học dùng để biểu diễn ngắn gọn phản ứng hoá học. Gồm công thức hóa học và hệ số thích hợp của những chất tham gia và chất tạo thành.
2. Cách bước lập phương trình hóa học
– Các bước lập phương trình hóa học:
+ Bước 1: Viết sơ đồ phản ứng gồm công thức hóa học của các chất phản ứng và sản phẩm.
+ Bước 2: Cân bằng số nguyên tử của các nguyên tố có trong phản ứng: Tìm hệ số thích hợp đặt trước các công thức.
+ Bước 3: Viết phương trình hóa học.
– Chú ý:
+ Không được thay đổi các chỉ số trong công thức hóa học đã viết đúng. Ví dụ như 3O2 (đúng) chuyển thành 6O (sai)
+ Viết hệ số cao bằng kí hiệu hóa học: Ví dụ như 4Al, 2Mg (đúng). Không viết 4Al, 2Mg (sai)
+ Trong các công thức hóa học có các nhóm nguyên tử như nhóm OH, SO4… Thì coi cả nhóm như một đơn vị để cân bằng, trước và sau phản ứng số nhóm nguyên tử phải bằng nhau.
II. Ý nghĩa của phương trình hóa học
Phương trình hóa học cho biết: Tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng. Tỉ lệ này đúng bằng tỉ lệ hệ số mỗi chất trong phương trình.
Dưới đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 trang 57 58 sgk Hóa học 8. Các bạn hãy đọc kỹ đầu bài trước khi giải nhé!
Bài tập
Giaibaisgk.com giới thiệu với các bạn đầy đủ phương pháp trả lời các câu hỏi, giải các bài tập hóa học 8 kèm bài giải, câu trả lời chi tiết bài 1 2 3 4 5 6 7 trang 57 58 sgk Hóa học 8 cho các bạn tham khảo. Nội dung chi tiết bài giải, câu trả lời từng bài tập các bạn xem dưới đây:
1. Giải bài 1 trang 57 sgk Hóa học 8
a) Phương trình hóa học biểu diễn gì, gồm công thức hóa học của những chất nào?
b) Sơ đồ của phản ứng khác với phương trình hóa học của phản ứng ở điểm nào?
c) Nêu ý nghĩa của phương trình hóa học?
Trả lời:
a) Phương trình hóa học biểu diễn ngắn gọn phản ứng hóa học, gồm công thức hóa học của chất phản ứng và sản phẩm phản ứng.
b) Sơ đồ của phản ứng khác với phương trình hóa học là chưa có hệ số thích hợp, tức là chưa cân bằng nguyên tử. Tuy nhiên có một số trường hợp thì sơ đồ cũng là phương trình hóa học.
c) Phương trình hóa học cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất trong phản ứng cũng như từng cặp chất trong phản ứng.
2. Giải bài 2 trang 57 sgk Hóa học 8
Cho sơ đồ của các phản ứng sau:
a) Na + O2 → Na2O.
b) P2O5 + H2O → H3PO4.
Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử, số phân tử của các chất trong mỗi phản ứng.
Bài giải:
Phương trình hóa học của phản ứng:
a) 4Na + O2 → 2Na2O
Số nguyên tử Na : số phân tử oxi : số phân tử Na2O là 4 : 1 : 2
b) P2O5 + 3H2O → 2H3PO4
Số phân tử P2O5 : số phân tử H2O : số phân tử H3PO4 là 1 : 3 :2
3. Giải bài 3 trang 58 sgk Hóa học 8
Yêu cầu làm như bài tập 2 theo sơ đồ của các phản ứng sau:
a) HgO → Hg + O2.
b) Fe(OH)3 → Fe2O3 + H2O
Bài giải:
Phương trình hóa học của phản ứng:
a) 2HgO → 2Hg + O2.
Số phân tử HgO : số nguyên tử Hg : số phân tử O2 là 2 : 2 :1
b) 2Fe(OH)3 → Fe2O3 + 3H2O.
Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O là 2 : 1 : 3
4. Giải bài 4 trang 58 sgk Hóa học 8
Cho sơ đồ phản ứng sau:
Na2CO3 + CaCl2 → CaCO3 + NaCl
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số phân tử của 4 cặp chất trong phản ứng (tùy chọn).
Bài giải:
a) Phương trình hóa học của phản ứng:
Na2CO3 + CaCl2 → CaCO3 + 2NaCl.
b) Số phân tử Na2CO3 : số phân tử CaCl2 là 1 : 1
Số phân tử CaCO3 : số phân tử NaCl là 1 : 2
Số phân tử Na2CO3 : số phân tử NaCl là 1 : 2
Số phân tử CaCl2: Số phân tử CaCO3 là 1 : 1
5. Giải bài 5 trang 58 sgk Hóa học 8
Biết rằng kim loại magie Mg tác dụng với axit sunfuric H2SO4 tạo ra khí hiđro H2 và chất magie sunfat MgSO4.
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số nguyên tử magie lần lượt với số phân tử của ba chất khác trong phản ứng.
Bài giải:
a) Phương trình hóa học của phản ứng:
Mg + H2SO4 → MgSO4 + H2
b) Số nguyên tử Mg : số phân tử H2SO4 là 1 : 1
Số nguyên tử Mg : số phân tử MgSO4 là 1 : 1
Số nguyên tử Mg : số phân tử H2 là 1 : 1
6. Giải bài 6 trang 58 sgk Hóa học 8
Biết rằng photpho đỏ P tác dụng với khí oxi tạo hợp chất P2O5.
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ số nguyên tử P lần lượt với số phân tử của hai chất khác trong phản ứng.
Bài giải:
a) Phương trình hóa học của phản ứng:
4P + 5O2 → 2P2O5.
b) Số nguyên tử P : số phân tử oxi : số phân tử P2O5 là 4 : 5 : 2
7. Giải bài 7 trang 58 sgk Hóa học 8
Hãy chọn hệ số và công thức hóa học và thích hợp đặt vào những chỗ có dấu hỏi trong các phương trình hóa học sau (chép vào vở bài tập)
a) ?Cu + ? → 2CuO
b) Zn + ?HCl → ZnCl2 + H2
c) CaO + ?HNO3 → Ca(NO3)2 + ?
Bài giải:
Phương trình hóa học của phản ứng:
a) 2Cu + O2 → 2CuO
b) Zn + 2HCl → ZnCl2 + H2
c) CaO + 2HNO3 → Ca(NO3)2 + H2O.
Câu trước:
Câu tiếp theo:
Xem thêm:
- Giải các bài tập Hóa học lớp 8 khác
- Để học tốt môn Toán lớp 8
- Để học tốt môn Vật lí lớp 8
- Để học tốt môn Sinh học lớp 8
- Để học tốt môn Ngữ văn lớp 8
- Để học tốt môn Lịch sử lớp 8
- Để học tốt môn Địa lí lớp 8
- Để học tốt môn Tiếng Anh lớp 8
- Để học tốt môn Tiếng Anh lớp 8 thí điểm
- Để học tốt môn Tin học lớp 8
- Để học tốt môn GDCD lớp 8
Trên đây là phần Hướng dẫn Giải bài 1 2 3 4 5 6 7 trang 57 58 sgk Hóa học 8 đầy đủ và ngắn gọn nhất. Chúc các bạn làm bài môn Hóa học lớp 8 thật tốt!
“Bài tập nào khó đã có giaibaisgk.com“
