Nội Dung
Hướng dẫn giải Bài 12: Mối quan hệ giữa các loại chất vô cơ, sách giáo khoa Hóa học 9. Nội dung bài Giải bài 1 2 3 4 trang 41 sgk Hóa học 9 bao gồm đầy đủ lý thuyết, công thức, phương trình hóa học, chuyên đề hóa học, … có trong SGK để giúp các em học sinh học tốt môn hóa học lớp 9, ôn thi vào lớp 10 THPT.
Lý thuyết
I. Mối quan hệ giữa các loại hợp chất vô cơ

II. Những phản ứng hoá học minh họa
1. CaO +2 HCl → CuCl2 +H2O
2. CO2 + 2NaOH → Na2CO3 + H2O
3. K2O + H2O → 2KOH
4. Cu(OH)2 → CuO + H2O
5. SO3 + H2O → H2SO4
6. Mg(OH)2 + H2SO4 → MgSO4 + 2H2O
7. CuSO4 + 2NaOH → Cu(OH)2 + Na2SO4
8. AgNO3 + HCl → AgCl + HNO3
9. H2SO4 + ZnO → ZnSO4 + H2O
Dưới đây là phần Hướng dẫn Giải bài 1 2 3 4 trang 41 sgk Hóa học 9. Các bạn hãy đọc kỹ đầu bài trước khi giải nhé!
Bài tập
Giaibaisgk.com giới thiệu với các bạn đầy đủ phương pháp trả lời các câu hỏi, giải các bài tập hóa học 9 kèm bài giải, câu trả lời chi tiết bài 1 2 3 4 trang 41 sgk Hóa học 9 cho các bạn tham khảo. Nội dung chi tiết câu trả lời, bài giải từng bài tập các bạn xem dưới đây:
1. Giải bài 1 trang 41 sgk Hóa học 9
Chất nào trong những thuốc thử sau đây có thể dùng để phân biệt dung dịch natri sunfat và dung dịch natri cacbonat?
a) Dung dịch bari clorua.
b) Dung dịch axit clohiđric.
c) Dung dịch chì nitrat.
d) Dung dịch bạc nitrat.
e) Dung dịch natri hiđroxit.
Bài giải:
– Không dùng BaCl2 và Pb(NO3)2 vì đều xảy ra phản ứng và tạo kết tủa có màu giống nhau.
BaCl2 + Na2SO4 \(\to\) BaSO4↓ + 2NaCl
BaCl2 + Na2CO3 \(\to\) BaCO3↓ + 2NaCl
Pb(NO3)2 + Na2SO4\(\to\) PbSO4↓ + 2NaNO3
Pb(NO3)2 + Na2CO3\(\to\) PbCO3↓ + 2NaNO3
– Không dùng AgNO3, vì đều xảy ra phản ứng, hiện tượng không khác nhau rõ rệt; Ag2CO3 không tan, Ag2SO4 ít tan và có màu giống nhau.
2AgNO3 + Na2SO4 \(\to\) Ag2SO4 + 2NaNO3
2AgNO3 + Na2CO3 \(\to\) Ag2CO3 + 2NaNO3
– Không dùng NaOH, vì đều không phản ứng, không có hiện tượng gì.
– Thuốc thử dùng được là dung dịch HCl vì HCl tác dụng với Na2CO3 có xuất hiện bọt khí và không tác dụng với Na2SO4.
2HCl + Na2CO3 → 2NaCl + CO2↑ H2O.
HCl + Na2SO4 không phản ứng
2. Giải bài 2 trang 41 sgk Hóa học 9
a) Cho các dung dịch sau đây phản ứng vời nhau từng đôi một, hãy ghi dấu (x) nếu có phản ứng xảy ra, dấu (0) nếu không có phản ứng:
| NaOH | HCl | H2SO4 | |
| CuSO4 | |||
| HCl | |||
| Ba(OH)2 |
b) Viết các phương trình hóa học (nếu có).
Bài giải:
| NaOH | HCl | H2SO4 | |
| CuSO4 | X | O | O |
| HCl | X | O | O |
| Ba(OH)2 | O | X | X |
b) Phương trình phản ứng:
CuSO4 + 2NaOH → Cu(OH)2 ↓ + Na2 SO4
HCl + NaOH → NaCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2 O
Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O.
3. Giải bài 3 trang 41 sgk Hóa học 9
Viết phương trình hóa học cho những chuyển đổi hóa học sau:
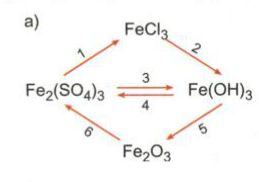

Bài giải:
a) Phương trình hóa học:
(1) Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4↓
(2) FeCl3 + 3NaOH → 3NaCl + Fe(OH)3↓
(3) Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
(4) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O
(5) 2Fe(OH)3 \(\overset{t^{o}}{\rightarrow}\) Fe2O3 + 3H2O
(6) Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
b) Phương trình hóa học:
(1) 2Cu + O2 \(\overset{t^{o}}{\rightarrow}\) 2CuO
(2) CuO + H2 \(\overset{t^{o}}{\rightarrow}\) Cu+ H2O
(3) CuO + 2HCl → CuCl2 + H2O
(4) CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
(5) Cu(OH)2 + 2HCl → CuCl2 + 2H2O
(6) Cu(OH)2 \(\overset{t^{o}}{\rightarrow}\) CuO + H2O
4. Giải bài 4* trang 41 sgk Hóa học 9
Có những chất: Na2O, Na, NaOH, Na2SO4, Na2CO3, NaCl.
a) Dựa vào mối quan hệ giữa các chất, hãy sắp xếp các chất trên thành một dãy chuyển đổi hóa học.
b) Viết các phương trình hóa học cho dãy chuyển đổi hóa học ở câu a.
Bài giải:
a) Dãy chuyển hóa trên có thể là:
Na \(\overset{+O_{2}}{\rightarrow}\) Na2O \(\overset{+H_{2}O}{\rightarrow}\) NaOH \(\overset{+CO_{2}}{\rightarrow}\) Na2CO3 \(\overset{+H_{2}SO_{4}}{\rightarrow}\) Na2SO4 \(\overset{+BaCl_{2}}{\rightarrow}\) NaCl
b) Các phương trình hóa học:
4Na + O2 → 2Na2O
Na2O + H2O → 2NaOH
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2SO4 → Na2SO4 + CO2↑ + H2O
Na2SO4 + BaCl2 → 2NaCl + BaSO4↓
Bài trước:
Bài tiếp theo:
Xem thêm:
- Giải các bài tập Hóa học lớp 9 khác
- Để học tốt môn Toán lớp 9
- Để học tốt môn Vật lí lớp 9
- Để học tốt môn Sinh học lớp 9
- Để học tốt môn Ngữ văn lớp 9
- Để học tốt môn Lịch sử lớp 9
- Để học tốt môn Địa lí lớp 9
- Để học tốt môn Tiếng Anh lớp 9
- Để học tốt môn Tiếng Anh lớp 9 thí điểm
- Để học tốt môn Tin học lớp 9
- Để học tốt môn GDCD lớp 9
Trên đây là phần Hướng dẫn Giải bài 1 2 3 4 trang 41 sgk Hóa học 9 đầy đủ và ngắn gọn nhất. Chúc các bạn làm bài môn Hóa học lớp 9 thật tốt!
“Bài tập nào khó đã có giaibaisgk.com“

